초기 임상단계, 2~3상 결과 지켜봐야
국내 임상 13건 진행…치료제 11건·백신 2건
식약처 "혈장치료제, 임상시험 신청 시 신속 승인"
[우먼컨슈머=박우선 기자] 전 세계에서 가장 빠르게 임상 3상에 진입한 아스트라제네카의 코로나19 백신이 임상 1/2상 결과, 심각한 부작용 없이 안전성과 면역원성이 확인됐다.
식품의약품안전처는 22일 이 같은 내용을 포함한 코로나19 치료제·백신의 임상시험 및 심사 현황을 공개했다.
글로벌 제약사 아스트라제네카가 영국 옥스퍼드 대학과 개발 중인 이 백신은 현재 임상 2상 및 3상 진행 중이다.
최근 발표한 1/2상 임상시험 결과, 18세~55세의 건강한 성인 1077명에 투여했더니 대부분의 접종자에게서 적절한 수준의 안전성과 면역원성이 확인됐다. 백신을 투여받은 사람에게서 통증, 열감, 오한, 근육통 등 백신 접종 후 나타나는 일반적인 이상반응이 발생했지만 심각한 부작용은 없었다.
식약처는 “바이러스를 제거할 수 있는 중화항체가 대부분의 접종자에게서 생성된 점 등 현재까지 결과들이 긍정적이긴 하지만 아직은 초기 임상단계라서 2상 및 3상 결과를 더 지켜봐야 한다”고 제언했다.
현재 국내 SK바이오사이언스가 이 백신의 위탁제조를 맡기로 해, 상용화 시 전 세계에 공급할 예정이다. 이 백신은 바이러스 벡터를 이용한 백신으로, 세포배양 기술로 생산된다.
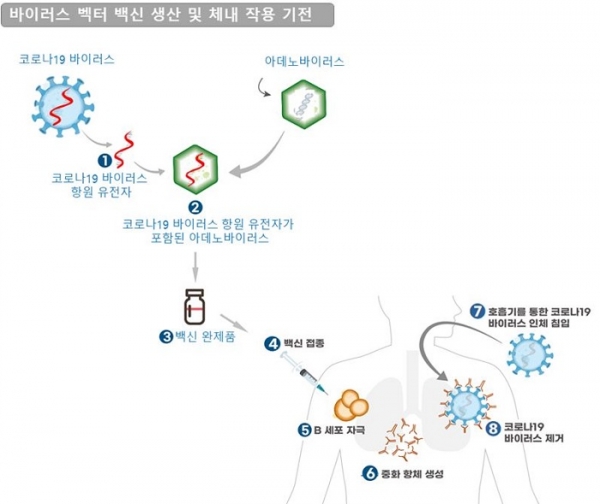
바이러스 벡터 백신의 작용 기전은 이렇다. 먼저 코로나19 바이러스의 항원 유전자를 제조한 후 이를 아데노바이러스에 넣어준다. 아데노바이러스는 코로나19 바이러스의 항원 유전자를 인체 세포 내로 운반하는 역할을 한다. 이후 바이러스를 증식시켜 정제 후 바이알에 담아 제품화하는 과정이다. 사람이 이를 접종하면, 인체 내로 들어온 백신의 항원 성분들이 B세포를 자극한다. 자극된 B세포에서 바이러스를 제거할 수 있는 중화 항체를 만들어 몸속에 보관한다. 그러다 코로나19 바이러스가 호흡기를 통해 침입했을 때, 몸속의 중화 항체가 침입한 바이러스를 제거하는 작용 기전이다.
◇국내 임상 13건…“혈장치료제 임상, 신속 승인할 것”
한편, 국내에서 개발 중인 코로나 치료제 및 백신의 임상시험은 지난 17일 셀트리온의 항체치료제(CT-P59)가 승인되면서 13건으로 늘었다. 치료제 11건, 백신 2건이다.
이 중 코로나19 완치자의 혈액을 이용해 개발된 치료제로는 ‘혈장분획 치료제’와 ‘항체 치료제’가 있다.
혈장분획 치료제는 코로나19 완치자의 혈액 중 혈장을 대량으로 수집한 후 여러 공정을 거쳐 코로나19 중화항체를 농축한 제제다. 현재 GC녹십자가 혈장분획 치료제를 개발 중이다. 임상시험 계획 신청을 위해 식약처와 사전상담을 진행 중이다. 완치자의 혈장을 수집해 7월 중순부터 임상시험용 의약품 생산을 개시했다.
식약처는 “동일 원리를 적용한 제품이 예전부터 사용되고 있어, 1상 시험을 면제했다”며 “임상시험이 신청되면 신속하게 검토해 안전성이 충분히 확보된다고 판단되면 임상시험 계획을 승인할 예정”이라고 말했다.
해외에선 현재 프랑스 및 이탈리아 등에서 5건의 혈장분획 치료제 임상시험이 진행 중이다.
항체 치료제는 완치자의 혈액에서 가장 강력한 바이러스 중화능력을 보이는 중화항체를 선별하고, 그 항체 유전자를 삽입한 세포를 배양해 항체를 대량 생산하는 것을 말한다. 완치자의 혈액 수급과 무관하게 안정적으로 양질의 의약품을 대량 생산 및 공급할 수 있는 장점이 있는 반면 생산에 많은 비용이 투입되는 단점도 있다.
국내에서 셀트리온의 항체치료제가 최근 1상을 승인받아, 인체 임상에 돌입한다. 세포 실험 결과, 바이러스 감염을 차단하는 것으로 나타났다. 족제비와 햄스터를 사용한 동물실험에서는 바이러스 수치를 낮추고 염증을 감소시켰다. 특히 사람과 유사한 임상적 증상을 나타내는 족제비에서 콧물, 기침 등이 개선됐다. 원숭이를 이용한 독성시험에서 안전성도 확인됐다.
해외에선 미국 L사와 R사가 개발한 항체치료제가 건강한 사람 또는 환자를 대상으로 임상시험을 진행 중이다.

